陈良团队发现新型PD-1的小分子抑制剂
2020-05
文章来自:新利体育官网 阅读次数:2219
PD-1是当今的肿瘤免疫中当之无愧的明星分子。利用抗体阻断PD-1的功能已在临床中应用,有诸多针对PD-1或PD-L1的抗体药物已在临床获批,且将呈现爆发式的增长。然而抗体类药物有其固有的弱点:组织穿透能力弱,较难到达肿瘤部位;生产/储存/运输的成本高;部分病人因为体内的抗体结合了PD-1的抗体药导致药物失效,并且产生的免疫复合物引起病人的肝肾毒性;抗体需要静脉注射,因此病人服用不方便。相对于抗体,小分子容易克服上述弱点。PD-1的小分子抑制剂是第二代PD-1药物的发力点。但目前针对免疫治疗靶点蛋白的小分子药物大多阻断PD-1与PD-L1的结合,设计小分子的策略还很不成熟,是否有其他策略可以为设计PD-1通路的抑制剂还有待研究。近日,暨南大学陈良实验室、丁克实验室和中山大学的周鹏辉实验室联合在EMBO Molecular Medicine上发表了“Blocking interaction between SHP2 and PD-1 denotes a novel opportunity for developing PD-1 inhibitors”的文章,阐述了小分子阻断PD-1招募SHP2这一PD-1传导信号的关键步骤导致PD-1功能抑制,并且鉴定了亚甲基蓝能强烈的阻断这一关键步骤。
研究人员构建了由T细胞和抗原呈递细胞组成的、基于荧光素酶活力的高通量的PD-1功能筛选体系。该系统中,PD-1的活力抑制了被抗原呈递细胞刺激所引发TCR信号传导,只有在PD-1的信号传导过程被抑制,T细胞中的荧光素酶才能激活(图1)。
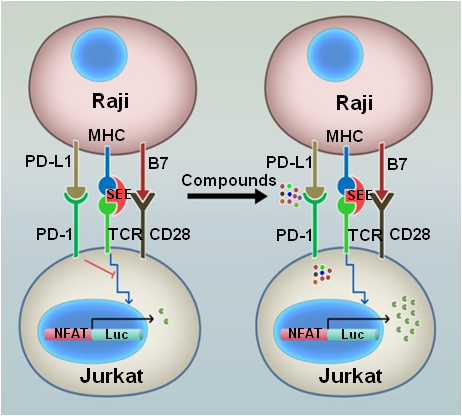
图1. FDA化合物筛选模式图
利用这系统,研究人员高通量筛选了小分子化合物库,并鉴定到亚甲基蓝能强烈地激活T细胞的荧光素酶活力。提示亚甲基蓝能抑制PD-1的功能。
为例证实上述猜想,研究人员利用高表达PD-1的转基因T细胞杀伤表达PD-L1的靶细胞测定了亚甲基蓝的活力,结果发现在T细胞杀伤淋巴瘤细胞和黑色素瘤细胞过程中亚甲基蓝都能强烈的通过抑制PD-1的功能而增强T细胞的杀伤能力。
亚甲基蓝是如何抑制PD-1的功能的呢?目前临床上用的抗体大多通过阻断PD-1与PD-L1的相互作用。然而,作用通过FACS,ELISA等实验排除了这种可能性。
T细胞表面的PD-1在PD-L1的刺激下,胞内区的Y248被磷酸化,进而招募SHP2,SHP2的磷酸酶的功能被激活后,通过去磷酸化灭活了TCR下游的信号传递元件。研究人员通过免疫共定位、免疫共沉淀和ELISA证实亚甲基蓝阻断了Y248位磷酸化的PD-1与SHP2的相互作用。亚甲基蓝能恢复T细胞受体下游的信号传导。
体内实验发现,亚甲基蓝能有效促通过抑制PD-1的功能而促进激活的T细胞在体内清除高表达PD-L1的淋巴瘤(图2A)。亚甲基蓝还能通过增强CD8+T细胞的功能从而有效治疗原发性肺癌(图2B)。
研究人员也发现亚甲基蓝能有效的恢复人外周血中的T细胞的分裂与细胞因子的分泌。
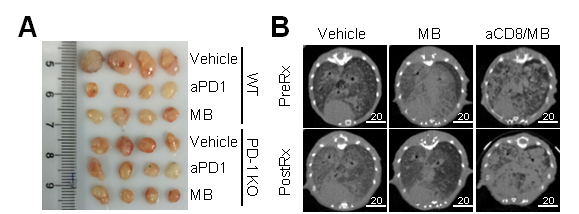
图2. 亚甲基蓝能有效消除体内移植瘤及原发肿瘤
A. 亚甲基蓝有效缩小EG7-PD-L1移植瘤;B. 亚甲基蓝有效消退EGFR-L858R原发性肺癌。
本研究中,研究人员鉴定到亚甲基蓝这个老药有PD-1抑制剂的作用,为其通过抑制PD-1在临床中治疗肿瘤提供了一个新思路。亚甲基蓝通过抑制PD-1与SHP2的相互作用阻断PD-1的信号传导,也为药学界设计PD-1的抑制剂开创了一个新策略(图3)。
图3. MB有效阻断PD-1与SHP2的相互作用
暨南大学的范真真与田娅慧是本文的第一作者,陈智鹏,刘鹭,周倩,李楠,黄俊奇,张志明,中山大学的何晶晶,高嵩,中科院生化细胞所的许琛琦,英国东英吉利大学的 James Coleman和董长江参与本研究,暨南大学的陈良、丁克和中山大学的周鹏辉为本文的共同通讯作者。本工作受到国家自然科学基金(81672309,81972778,31800723,31701174)、广东省民生项目 (2017B020227001)、广东省科技计划重点项目(2017B020227001)、暨南大学中央高校基本科研业务费(21618326)的支持。
原文的链接: https://www.embopress.org/doi/10.15252/emmm.201911571


